กายวิภาคศาสตร์ใบและลำต้นของพืชเบียนวงศ์กาฝาก (Loranthaceae) ในจังหวัดอุบลราชธานี
Main Article Content
Abstract
Wirot Kesonbua, Puttisan Suriyon and Preyanuch Lakhunthod
รับบทความ: 7 ตุลาคม 2567; แก้ไขบทความ: 20 มกราคม 2568; ยอมรับตีพิมพ์: 25 มกราคม 2568; ตีพิมพ์ออนไลน์: 4 มิถุนายน 2568
บทคัดย่อ
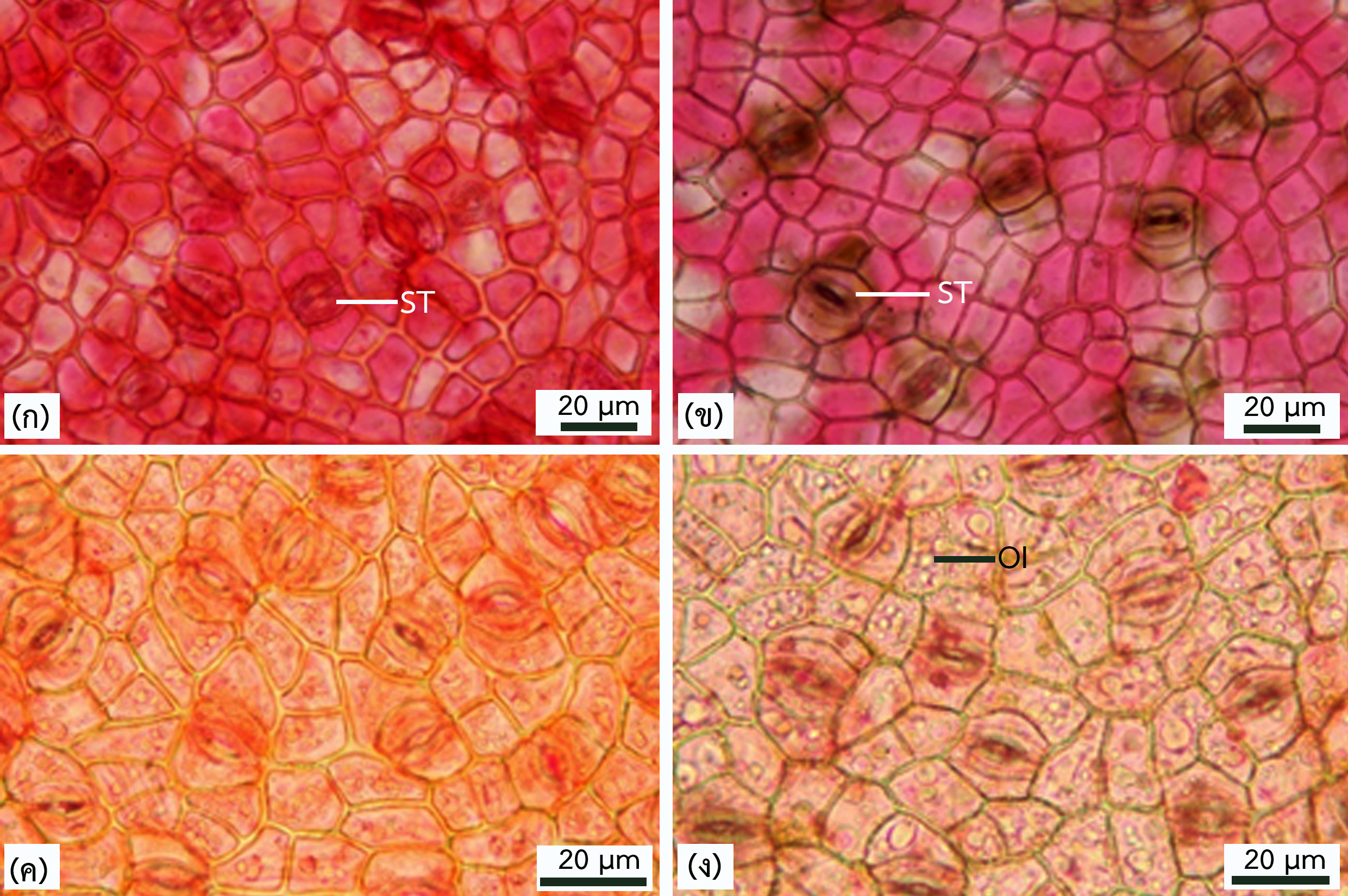
จากการศึกษาลักษณะกายวิภาคศาสตร์ใบและลำต้นของพืชเบียนวงศ์กาฝากบริเวณพื้นที่ป่า เต็งรังในจังหวัดอุบลราชธานี จำนวน 4 ชนิด ได้แก่ Dendrophthoe pentandra (L.) Miq. Helixanthera parasitica Lour. Macrosolen cochinchinensis (Lour.) Tiegh. และ Scurrula atropurpurea (Blume) Danser โดยวิธีการลอกผิวใบและตัดตามขวางด้วยใบมีดโกนและกรรมวิธีพาราฟิน พบลักษณะทั่วไปของพืชที่ศึกษาคือ เซลล์ในเนื้อเยื่อชั้นผิวใบทั้งสองด้านมีรูปร่างหลายเหลี่ยมหรือรูปร่างไม่แน่นอน ผนังเซลล์เรียบหรือเว้า ปากใบเป็นแบบพาราไซติก พบในเนื้อเยื่อชั้นผิวใบทั้งสองด้าน อยู่ระดับเดียวกับเนื้อเยื่อชั้นผิว บางชนิดมีสารสะสมเป็นเซลล์เม็ดน้ำมันและบางชนิดมีไทรโคมเป็นปุ่มเล็ก ชั้นมีโซฟิลล์ประกอบด้วยเซลล์ที่มีรูปแบบเดียว หรือสองแบบที่มีใบสองหน้าเหมือนกันและใบสองหน้าต่างกัน มัดท่อลำเลียงบริเวณเส้นกลางใบมี 3–6 มัด เนื้อเยื่อชั้นผิวของก้านใบไม่มีไทรโคมหรือมีไทร-โคมแบบหลายเซลล์ ชั้นคอร์เทกซ์เป็นเนื้อเยื่อพาเรงคิมาที่เซลล์มีผนังบาง พบโครงสร้างสารหลั่งกระจายอยู่ทั่วไป มัดท่อลำเลียงบริเวณก้านใบมีจำนวนมัดเดียวหรือหลายมัด พบสารสะสมเป็นแบบผลึกรูปปริซึมกระจายรอบ ชั้นเพริเดิร์มของลำต้นมีเลนติเซลกระจายทั่วไป บางชนิดมีสารสะสมติดสีแดงเข้มในชั้นเฟลโลเดิร์ม โฟลเอ็มมีเซลล์เส้นใยผนังหนาล้อมรอบ วงปีไม่ชัดเจน เซลล์เวสเซลมีรูปร่างกลมหรือรี มีรูปแบบเป็นแบบเดี่ยว แบบแฝด และแบบกลุ่ม การเรียงตัวของเวสเซลเป็นแบบกระจาย พาเรงคิมาในแนวรัศมีมี 1–8 แถว พบสารสะสมแบบผลึกรูปปริซึมในเซลล์บริเวณไส้ไม้ โครงสร้างที่สามารถนำไปใช้สร้างรูปวิธานสำหรับการระบุชนิด ได้แก่ ไทรโคม ชั้นมีโซฟิลล์ และจำนวนมัดท่อลำเลียงของก้านใบ กายวิภาคศาสตร์ของพืชวงศ์กาฝากแสดงลักษณะของพืชทนแล้ง พืชน้ำ และพืชที่ชื้นปานกลาง เป็นการปรับตัวของพืชเบียนที่เกาะอาศัยอยู่บนพืชให้อาศัยเพื่อสามารถดำรงชีวิตในแหล่งที่อยู่อาศัยย่อยที่มีสภาพแวดล้อมเฉพาะภายในระบบนิเวศของป่าเต็งรัง
คำสำคัญ: กายวิภาคศาสตร์พืช พืชเบียน วงศ์กาฝาก การปรับตัว
Abstract
Anatomical studies of the leaves and stems of four species of parasitic plants in the family Loranthaceae found in the deciduous forest of Ubon Ratchathani province, namely Dendrophthoe pentandra (L.) Miq., Helixanthera parasitica Lour., Macrosolen cochinchinensis (Lour.) Tiegh., and Scurrula atropurpurea (Blume) Danser, were conducted using epidermal peeling, transverse sections prepared through freehand sectioning and the paraffin process. The general characteristics of the plants studied include polygonal or irregularly shaped cells in both surface tissues. The cell walls are smooth or curved. The stomata are paracytic and found on both surfaces, with typical stomata. Some species have substances that accumulate as oil droplets, and some have papillae trichomes. The mesophyll layer consists of cells with a single pattern or two types, with unifacial or bifacial leaf. There are 3–6 vascular bundles in the leaf midrib. The epidermis of the petioles is either glabrous or covered with multicellular trichomes. The cortical layer comprises thin–walled parenchyma cells, and secretory structures are scattered throughout. There are 1 to several vascular bundles in the leaf petiole. Accumulated substances were observed in the form of prism–shaped crystals distributed around the vascular bundles. The stem periderm contains lenticels scattered throughout. In some species, dark red accumulated substances are presence in the phelloderm layer. The phloem is surrounded by thick-walled fibers. The annual rings are indistinct. The vessel cells are round or oval in shape, and there is solitary, paired, and clustered vessels. The vessel arrangement in wood is diffuse–porous wood. The radial parenchyma has 1 to 8 rows. Prismatic crystal deposits are found in the cells of the pith. Structures that can be used to construct a key for species identification include trichomes, mesophyll, and the number of vascular bundles in the petioles. The anatomy of the family exhibits characteristics of drought–tolerant plants, aquatic plants, and moderately moist plants. It represents an adaptation of parasitic plants that live on host plants, enabling them to survive in microhabitats with specific environmental conditions within deciduous forest ecosystem.
Keywords: Plant anatomy, Parasitic plants, Loranthaceae, Adaptation
Downloads
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
References
Barlow, B. A. (2002). Loranthaceae. In Santisuk, T. and Larsen, K. (Eds.), Flora of Thailand (pp. 665–706). Bangkok: Prachachon.
Borrelli, N., Benvenuto, M. L., and Osterrieth, M. (2016). Calcium oxalate crystal production and density at different phenological stages of soybean plants (Glycine max L.) from the southeast of the Pampean Plain, Argentina. Plant Biology 18(6): 1016–1024.
Chaikoolvatana, A., Singhasivanonb, P., and Haddawyc, P. (2007). Utilization of a geographical information system for surveillance of Aedes aegypti and dengue haemorrhagic fever in north–eastern Thailand. Dengue Bulletin 31: 75–82.
Cutter, E. G. (1978). Plant Anatomy. Part I. Cells and Tissues. London: Edward Arnold.
Danser, B. H. (1933). A new system for the genera of Loranthaceae–Loranthoideae, with a nomenclator for the old world species of this subfamily. Verhandelingen der Koninklijke Akademie van Wetenschappen te Amsterdam Afdeeling Natuurkunde Section 2 (pp. 1–128), Amsterdam.
Darwin, C. R. (1859). On the Origin of Species by Means of Natural Selection, or the Preservation of Favored Races in the Struggle for Life. London: John Murray.
Esau, K. (1977). Anatomy of Seed Plants. Hoboken: John Wiley & Sons.
Fahn, A. (1982). Plant Anatomy. Oxford: Pergamon.
Franceschi, V. (2001). Calcium oxalate in plants. Trends in Plant Science 6(7): 331.
Girija, T., and Vijaya, V. C. (2014). Stomatal distribution in selected Loranthaceae members and its significance on parasitism. Environmental Science: Indian Journal 9(6): 211–214.
Hostanska, K., Gabius, H. J., Berki, T., and Palinkas, L. (1995). A plant lectin derived from Viscum album induces cytokine gene expression and protein production in cultures of human peripheral blood mononuclear cells. Nature Immunology 14(5–6): 295–304.
Ibrahim, J. A., and Ayodele, A. E. (2013). Taxonomic significance of leaf epidermal characters of the family Loranthaceae in Nigeria. World Applied Sciences Journal 24(9): 1172–1179.
Ibrahim, J. A., Kunle, O. F., and Ayodele, A. E. (2015). Anatomical features of the transverse sections of the leaves of Loranthaceae in Nigeria. International Journal of Pharmacognosy and Phytochemical Research 7(3): 489–501.
Ivanova, L. A., and P’yankov, V. I. (2001). Structural adaptation of the leaf mesophyll to shading. Russian Journal of Plant Physiology 49(3): 419–431.
Johansson, J. T. (1940). Plant Microtechnique. New York: McGraw–Hill.
Kesonbua, K., and Kodkaew, Y. (2022). Leaf epidermal anatomy for the identification of some medicinal plant in Ubon Ratchathani University. Journal of Science and Technology, Ubon Ratchathani University 24(1): 17–33. (in Thai)
Kesonbua, K., Tanuchon, D., and Srinual, A. (2023). Types and distribution of calcium oxalate crystals in leaves of some medicinal plants. Journal of Science and Technology, Ubon Ratchathani University 25(2): 38–48. (in Thai)
Kuijt, J. (1969). The biology of parasitic flowering plants. Berkeley: University of California.
Kwanda, N., Noikotr, K., Sudmoon, R., Tanee, T., and Chaveerach, A. (2013). Medicinal parasitic plants on diverse hosts with their usages and barcodes. Journal of Natural Medicines 67(3): 438–445.
Lersten, M. R., and Curtis, J. D. (2001). Idioblast and other unusual internal folia secretory structures in Scrophulariaceae. Plant Systematics and Evolution 227: 63–73.
Liu, B., Le, C. T., Barrett, R. L., Nickrent, D. L., Chen, Z., Lu, L., and Vidal–Russell, R. (2018). Historical biogeography of Loranthaceae (Santalales): Diversification agrees with emergence of tropical forests and radiation of songbirds. Molecular Phylogenetics and Evolution 124: 199–212.
Mathiasen, R. L., Nickrent, D. L., Shaw, D. C., and Watson, D. M. (2008). Mistletoes: pathology, systematics, ecology and management. Plant Disease 92(7): 988–1006.
Mott, K. A., Gibson, A. C., and O’Leary, J. W. (1982). The adaptive significance of amphistomatic leaves. Plant Cell and Environment 5: 455–460.
Park, J. H., Hyun, C. K., and Shin, H. K. (1999). Cytotoxic effects of the components in heat–treated mistletoe (Viscum album). Cancer Letters 139(2): 207–213.
Richardson, F., Brodribb, T. J., and Jordan, G. J. (2017). Amphistomatic leaf surfaces independently regulate gas exchange in response to variations in evaporative demand. Tree Physiology 37: 869–878.
Robabeh, S. S., Shahryar, S. M., and Narges G. (2012). Evidence from micromorphology and gross morphology of the genus Loranthus (Loranthaceae) in Iran. Turkish Journal of Botany 36: 655–666.
Sibinelli, V., and Ceccantini, G. (2022). Axial and radial wood maturation in three mistletoe ‘giants’ (Loranthaceae). IAWA Journal 43(1–2): 1–16.
Tubongbanua, R. M., Jr., Mendez, N. P., and Amoroso, V. B. (2023). Comparative morpho–anatomical studies of two Philippine endemic species of Amyema Tiegh. (Loranthaceae). Tropical Life Sciences Research 34(1): 139–150.
Vidal–Russell, R., and Nickrent, D.L. (2008). Evolutionary relationship in the showy mistletoe family (Loranthaceae). American Journal of Botany 95: 1015–1029.
Wongbutdee, J., Saengnill, W., Jittimanee, J., Panomket, P., and Saenwang, P. (2021). The association between the mapping distribution of melioidosis incidences and meteorological factors in an endemic area: Ubon Ratchathani, Thailand (2009–2018). Chiang Mai University Journal of Natural Sciences. 20(4): 1–12.
Zuch, D. T., Mazurek, R., and Zienkiewicz, A. (2022). Cell biology of the leaf epidermis: fate specification, morphogenesis, and coordination. The Plant Cell 34: 209–227.